摘要:卫生和健康事业发展有赖于先进医疗科学技术以及医疗材料的持续、快速、稳定的发展。伴随着我国医学科学技术水平的不断提升,聚乳酸材料凭借其环保性优势突破了传统医疗材料的应用框架、模式、种类的限制,已然在我国医学各领域之中得到了广泛推广与应用,并取得较多的实质性应用效果。
文章从乳酸直接缩聚法、乳酸催化法两种常见聚乳酸材料合成方式研究入手,从骨折内固定材料、眼科植入材料、组织工程支架材料、药物控释材料等方向阐述了聚乳酸材料在医学领域中具体应用,希望能够借此大力推动我国医疗事业向着持续、稳定、健康的方向发展。
关键词:聚乳酸材料;医学领域;眼科植入;生物相容性
引言
聚乳酸(Polylactic Acid,PLA)是一种人工合成的、可由微生物充分降解的热塑性脂肪族聚酯。其主要生产合成原料——乳酸具有显著的环保性、无毒无害、可再生以及良好的生物相容性应用特征优势。
聚乳酸材料在生物体内可被充分有效降解为二氧化碳和水。基于当前我国全面推进的现代化医疗服务体系建设规划和医疗基础设施建设规划,以及可持续发展战略的基本要求,聚乳酸材料在医学领域中将拥有着更加宽广的应用前景。
早在20世纪30年代,国外科研人员就已经开始 着手研究聚乳酸材料的合成和实际应用,但受限于当时的科技环境和生产成本,直至 20 世纪 80 年代末, 聚乳酸材料凭借现代化生产工艺的升级和其在人体降解产物的显著安全性应用成效才被世界各国接受。
1995年美国食品与药物管理局正式批准了聚乳酸以及其衍生物作为生物降解医用材料运用于临床。近些年来,聚乳酸材料凭借其良好的可塑性、环保性特征优势,在外科手术缝合线、药用控制系统、人造皮肤、眼科、牙科等相关医药学领域中,应用范围与应用比例大幅度提升。
此外,伴随着聚乳酸材料生产工艺技术的提升,以及在临床之中的广泛运用以及在相关科研人员、一线临床工作者的高度支持下,聚乳酸材料生长成本大幅度降低,为聚乳酸材料在医学领域中拥有更加宽广的应用前景提升了可能。
1、聚乳酸的合成
聚乳酸材料从环保性、能源性、安全性三个角度均具有着较高的应用优势,近年来,聚乳酸材料的合成与生产已然成为了化工与生物科研领域重要的研究 课题。当前,我国聚乳酸材料生产力求解决“无材可用”“有材不好用”“好材不敢用”等直接影响着聚乳酸材料在医学领域中的长期应用和可持续性供给的问 题。从聚乳酸材料合成层面来看,主要包括2种合成 方式,①乳酸直接缩聚法,②乳酸催化法(又称“丙 交酯开环聚合法”)
1.1 乳酸直接缩聚法
乳酸直接缩聚法,具有合成工艺操作简便,能够有效地降低聚乳酸材料的生产成本。但是,采用乳酸直接缩聚法在直接聚合过程之中有小分子产物—— H20 的存在,合成的聚乳酸材料的相对分子量小于 4000,强度过低,这使得其在医疗领域中的运用具有很大的局限性。
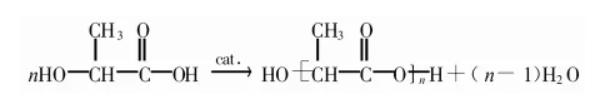
图1 乳酸直接缩聚法
1.2 乳酸催化法
乳酸催化法,又称“丙交酯开环聚合法”。采用 丙交酯开环聚合法是通过将乳酸脱水环化制成丙交酯,并且经过重新结晶过程之后,通过丙交酯开环聚合制成,实现了由低分子量聚乳酸到高分子量聚乳酸的提升。与乳酸直接缩聚法相比,丙交酯开环聚合法所得到的聚合乳酸分子量可以达到100万左右,强度 较高。因此,采用丙交酯开环聚合法生产的聚乳酸材料质量较高、应用范围较广,但是,由于丙交酯开环聚合法在制备过程之中需要加入大量催化剂及试剂,因此,成本较高。
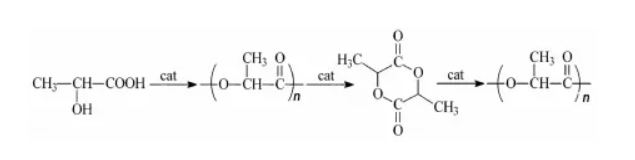
图2 丙交酯开环聚合法
2、医学领域的运用
2.1 骨折内固定材料
20世纪70年代,各国科研工作者开始尝试将可吸收聚合物作为骨折内固定材料进行医学应用探索。例如,将聚乳酸类材料制作的螺钉和板放置于狗的下 颌骨骨折处,进而观测聚乳酸类材料在狗下颌术后恢复之中生物降解效果。
但是,由于受当时科学技术发展整体水平以及聚乳酸生产工艺的局限,当时生产的 聚乳酸材料难以具备优良的延展性,在具体的医学实践应用中未能满足矫形外科骨折内固定的要求。然而,关于聚乳酸类材料在骨折类患者医治中的应用研究并未停止。
20世纪80年代,科研工作者与医学工作者的持续努力研究发现,左旋聚乳酸 (PLLA) 的降解速度比外消旋聚乳酸(PDLLA)缓慢,并且在与传统金属板钉骨折内固定材料相比,并无显著差异性。
因此,认为将左旋聚乳酸作为骨折内固定材料可取得更为优良的医疗效果。但是,后续研究证明,左旋聚乳酸 (PLLA) 后续缓慢降解过程之中,会出现 系列并发症。外消旋聚乳酸(PDLLA)作为具有更好生物相融性的特征,更为后续研究者所青睐。
骨折内固定材料作为能够直接将患者断骨内或外断骨固定以确保骨折端复位的材料,要求其具有实用性、稳定性、适配性等特征。传统骨折内固定材料一 般由不锈钢、钛及合金构成。此类骨折内固定材料与人体的骨骼生长环境、骨骼本身特质具有显著的差异性,即由不锈钢、钛或合金构成的传统骨折内固定材料,刚性与患者体内骨骼刚性不同。
这使得其虽然能够确保在患者体内保持正确的骨骼生长位置,但同时它也会破坏患者原有的骨骼应力分布环境,阻止患者周围骨痂形成速率,进而导致导致骨质疏松以及骨萎缩。因此,传统骨折内固定材料必须在患者病愈后 (后愈合阶段) 进行二次手术,取出固定装置,大大增加了患者的痛苦。
骨折内固定材料特征要求以及聚乳酸材料的主要特征对比可发现,聚乳酸材料由于具有优良的生物相容性,能够有效地适配于当前我国骨折患者医治环 境。将聚乳酸材料作为骨折内固定材料进行合理应用,将不会在患者体内产生排异反应。
相比传统的骨折内固定材料,聚乳酸材料可以充分契合患者体内的骨骼生长环境,同时,在将由聚乳酸材料制成的骨折内固定器置入患者体内后,可按照病愈时间调整骨折内固定器的降解速率,患者无需经历二次手术,可通过自身的生物代谢,将骨折内固定材料进行排除,因此,聚乳酸材料能在骨折类病患的医治中得以有效应用。
但是,聚乳酸类材料也有作为骨折内固定材料的应用缺陷,即如果患者出现大量骨质缺损状况时,如果仅采用聚乳酸类材料,则会因其不具有骨传导性的 特征,很难以为骨骼生长提供优良的环境并修复全骨。聚乳酸类材料在骨骼承力部位的应用效果不甚明显,不能满足新生骨骼的应力承受要求。另外,聚乳酸类材料在生物体内的降解速率不均衡,早期过快而 后期过慢。当新生骨组织生长发育后,仍有部分残留物存于患者体内,易引发并发症。
2.2 眼科植入材料
视网膜脱落作为致盲率极高的眼科疾病,在手术治疗存在较高的医治难度。传统视网膜脱落手术治疗过程中,一般采用眼巩膜表面植入硅橡胶和硅橡胶海绵填充物方式。硅橡胶和硅橡胶海绵的生物相容性较差,因此,在植入患者体内后往往会发生生物机体异物反应,不利于视网膜脱落患者术后恢复。
聚乳酸材料凭借其优良的生物降解性和生物相容性能够满足视网膜脱落眼科疾病的材料应用需求,解决传统填充材料在医治过程中出现的排异问题。
聚乳酸类材料的密度为 1.20~1.30kg/L,特性粘度 IV:0.2~8dL/g,同时,其还具有优良的拉伸强度和断裂伸长率,分别为 40~60MPa 和 4%~10%。过科学实验和系统测试发现,聚乳酸材料的弹性模量为 3000~4000MPa,弯曲模量为 100~150MPa,这种力学性能和理化性质决定了聚乳酸材料具有优良的热稳定性和抗溶剂性。
因此,在眼科类疾病医治过程中,聚乳酸材料可以应对复杂的手术环境和眼内环境,具有优良的抗异性和稳定性。根据华中科技大学同济医学院附属同济医院眼科陈建斌主治医师开展的相关实验表明,在5%,10%,20%的PDLLA盐酸左旋氧氟沙星眼内缓释植片的制备过程中,由聚乳酸材料制作的左旋氧氟沙星眼内缓释植片,在体外释药研究中具有优良的药物缓释性和结果表征。
另外,北京大学第三医院眼科中心刘瑜玲在探索生物降解性的阿霉素聚乳酸微球 (ADRPLA-MS) 对兔眼实验性增殖性玻璃体视网膜病变的防治作用实验中,实验结果表明,一次性注入含10g 阿霉素的生物降解性聚乳酸微球能够有效地减少牵引性视网膜脱离的发生率。
此外,将聚乳酸类材料作为眼科植入材料进行应用,还能够解决白内障、青光眼、角膜移植等眼科疾病,其在眼科中的应用具有优良的前景。
2.3 组织工程支架材料
伴随着我国组织工程与再生医学学科建设的快速发展,聚乳酸材料作为组织工程支架材料研究与各学科交叉与融合的重要组成部分,也得到科研人员与一 线医务人员的高度关注与广泛研究。
从方法层面来划分,组织工程大致可分为“纯活性细胞体系”“纯生物材料体系”以及“综合体系”。所谓“综合体系” 是指“生物材料与活动细胞融合的混杂体系”。当前,“综合体系”是组织工程之中最受关注。组织工程支架(scaffold for tissue engineering),是指“在组织工程中,为细胞生长输送营养及排泄代谢产物的三维多孔结构的细胞载体”。根据组织工程的基本要求,应用于人体的组织工程支架材料,必须具有优良的生物相容性和无毒性表征,聚乳酸材料可以有效地适配组织工程支架材料的各类具体应用需求。
聚乳酸材料在实际生产过程中操作灵活性较高,当前完全可以通过必要的科学技术和控制手段,生产出包覆纤维或多孔海绵体的医疗材料,能与组织活体细胞结合,并可植入生物体内,为细胞提供获取营养、气体交换、排泄废物和生长发育的场所,支持生物形成新的具有形态和功能的组织器官。同时,其凭借有孔结构和优良的机械强度、合理的几何形态满足生物组织工程支架在临床应用。
2.4 药物控释材料
理想药物释放体系需要具备如下功能与特质:① 药物控制释放功能,使血药浓度能维持在所需正常范围内;②药物靶向释放功能,使药物能够精准输送到 治疗目标部位;③补药量少;④毒副作用低;⑤服用方便,易于被患者接受;⑥在正常环境下,具有化学与物理稳定性。
药物控释材料是药物释放体系的重要组成部分,也是直接影响药效的主要因素。药物释放载体主要包含天然型载体和合成性载体,天然性载体一般由有机 材料、无机材料、高分子材料制成,而合成性载体主要由有机材料、无机材料、高分子材料、复合材料和 生物降解性和非生物降解性材料构成。
药物控释材料是保证药物以恒定速度在一定时间内从材料中释放的过程,实现药物控制释放,可以让药物在血液中保持对疾病治疗所需的最低浓度,保持 血药浓度恒定,避免了浓度偏高时药物中毒,偏低时治疗无效的问题。
通常条件下药物载体采用高分子材料时,高分子材料载体中药物含量的减少与释放速度的降低呈现正相关状态,药物释放速率往往呈现非恒量释放状态。如果采用可生物降解高分子材料(聚乳酸材料)替换普通高分子材料作为药物载体后,可生物降解高分子伴随着在患者体内逐渐降解,其共聚物结构会发生由紧凑到疏松的持续变化。
因此,可以通过控制药物释放速率与生物降解高分子载体之中药物减少量之间的比例,进而控制生物降解高分子载体结构的变动幅度,则可使载体内所含药物溶解与扩散阻力变小,进而实现药物长期恒量释放。
此外,末端没 有修饰的聚乳酸-羟基乙酸共聚物(PLGA)比末端修饰的聚乳酸-羟基乙酸共聚物有更小的突释和更大的释放率。根据聚乳酸材料的这一特点,可以通过选择药物与聚乳酸-羟基乙酸共聚物的结合方式控制药物的释放效率,呈现优良、稳定的治疗效果。
由此可见,聚乳酸材料具有生物相容性和生物降解性,降解产物能够满足无毒和不发生炎症反应的应用要求,聚乳酸材料的降解能够发生在一个合理的期 间内,具有可加工性、可消毒性以及良好的力学性能。
3、结语
伴随我国工业技术水平的提升、医疗科研水平的不断进步,加强聚乳酸材料的生产和研究,可打破原有的医疗材料应用框架限制以及临床应用限制,进而 切实改善与提升当前我国医疗环境水平。
同时,在日后的研究中,可将重点分析聚乳酸类材料的生物降解性,通过相关现代化手段和科学实验、研究理念,掌握聚乳酸材料的降解机理、合成工艺,使聚乳酸材料能够与生物医学和材料学进行有机结合。希望能够拓展聚乳酸类材料将在骨折内固定材料、眼科植入材料、组织工程支架材料、药物控释材料的应用范围。
免责声明:本图文、资料来源于网络,转载的目的在于传递更多信息及分享,并不代表本网站赞同其观点和对其真实性负责,也不构成其他建议。仅供交流,不为其版权负责。如涉及侵权,请及时与我们取得联系: zpia2008@163.com。